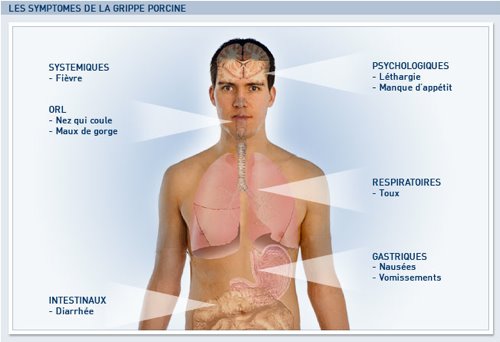
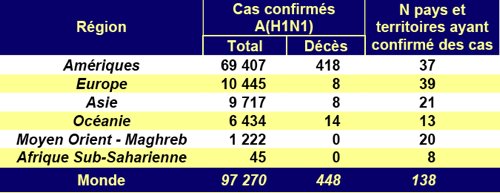
Ces adjuvants ont été ajoutés à l’antigène grippal pour augmenter la réaction immunitaire à dose d’antigène égale. En effet, c’est l’antigène (signature du virus) qui coûte cher à produire. Il ne s’agit pas de "couper" le produit, mais d’en augmenter l’impact sur le système immunitaire (et donc de produire plus de vaccins avec un même stock d’antigènes). Les adjuvants sont utilisés depuis longtemps avec d’autres vaccins traditionnels comme ceux contre le tétanos ou la coqueluche, l’adjuvant est alors de l’aluminium et la dose d’antigène n’est pas uniquement en cause.
Le vaccin Focetria ® du laboratoire Novartis, utilisé en Europe, qui est fabriqué près de Sienne, possède un adjuvant le MF59. Cet adjuvant, qui a pour effet de booster l’efficacité du vaccin en injectant moins de produit vaccinal, a un profil de sécurité établi, et appuyé par plus de 12 années de données cliniques de sécurité et plus de 40 millions de doses d'utilisation commerciale en Europe. Cet adjuvant a été étudié dans des essais cliniques impliquant plus de 26 000 personnes, dont des enfants, et a obtenu une licence pour une utilisation chez les personnes de 65 ans et plus dans le vaccin contre la grippe saisonnière, Fluad ®, depuis 1997 dans l'Union européenne. Fluad n'est pas homologué pour la vente aux Etats-Unis. Novartis a également l'intention de commencer la livraison de ses Fluvirin ® A (H1N1), vaccin monovalent pour le marché américain d'ici le début Octobre. La Food and Drug Administration américaine a approuvé ce vaccin, le 15 septembre, 2009. Les données provenant d'essais cliniques récents de Fluvirin réalisées au Costa Rica indiquent qu'une stratégie à dose unique est aussi efficace qu'une vaccination effectuée avec deux doses chez des âges adultes en bonne santé de 18 à 64 ans.
 Le vaccin Pandemrix ® du laboratoire Glaxo Smith Kline (GSK), qui est fabriqué à Dresde, possède un adjuvant le squalène. Cet adjuvant est un produit naturel jusqu’ici peu employé comme adjuvant indirect (émulsifiant). Il a néanmoins déjà été utilisé. L’OMS se veut rassurante sur son emploi. Cette argumentation paraît censée, mais l’on aimerait connaître les liens d’intérêt des auteurs de ce texte avec l’industrie du vaccin, très présente auprès des experts qui omettent le plus souvent de déclarer ces liens. D’aucuns font remarquer à juste titre qu’un produit naturel n’est pas forcément anodin lorsqu’il est injecté. Pour prendre un exemple caricatural, une faible dose de potassium injecté par voie veineuse provoque un décès immédiat.
Le vaccin Pandemrix ® du laboratoire Glaxo Smith Kline (GSK), qui est fabriqué à Dresde, possède un adjuvant le squalène. Cet adjuvant est un produit naturel jusqu’ici peu employé comme adjuvant indirect (émulsifiant). Il a néanmoins déjà été utilisé. L’OMS se veut rassurante sur son emploi. Cette argumentation paraît censée, mais l’on aimerait connaître les liens d’intérêt des auteurs de ce texte avec l’industrie du vaccin, très présente auprès des experts qui omettent le plus souvent de déclarer ces liens. D’aucuns font remarquer à juste titre qu’un produit naturel n’est pas forcément anodin lorsqu’il est injecté. Pour prendre un exemple caricatural, une faible dose de potassium injecté par voie veineuse provoque un décès immédiat.Le vaccin français du groupe Sanofi Pasteur, fabriqué sur deux sites, en France à Val-de-Reuil dans l'Eure et aux Etats-Unis, à Swiftwater en Pennsylvanie, manque toujours à l'appel des producteurs. « Ils sont partis un peu en retard et ont dû déposer un nouveau dossier. Le vaccin Panenza ® (dosé à 15 microgrammes, sans adjuvant de Sanofi recevra une autorisation nationale de mise sur le marché courant novembre. Celui contenant un adjuvant Humenza ® dosé à 3,8 microgrammes devrait être prêt vers la fin de l'année », a annoncé Philippe Lechat, directeur de l'évaluation de l'Afssaps.
Pour couper court aux rumeurs, l'Afssaps suggère de réserver les vaccins sans adjuvant aux populations à risque (femmes enceintes et personnes immunodéprimées). « Le Haut Conseil de la santé publique doit actualiser prochainement ses recommandations en fonction des nouvelles données », indique Jean Marimbert. Reste à convaincre une population hexagonale déroutée par la complexité du débat et la diversité des avis face à une épidémie jugée somme toute bénigne. « Nous avons trois semaines avant le démarrage de la campagne de vaccination pour informer la population », estime le directeur général de l'Afssaps.