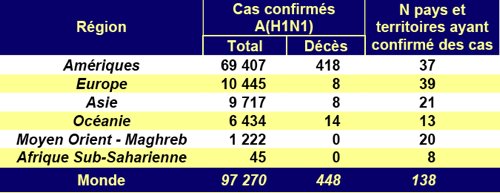
L’Agence européenne du médicament (EMEA) a annoncé, vendredi 25 septembre, qu’elle donnait son feu vert à deux vaccins contre le virus de la grippe A (H1N1) : Focetria, fabriqué par Novartis, et Pandemrix, de GlaxoSmithKline.
Elle recommande un schéma de vaccination en deux doses à trois semaines d’intervalle, chez l’adulte – y compris les femmes enceintes – et les enfants à partir de 6 mois, et attend des données complémentaires pour statuer sur l’administration d’une seule dose de vaccin.
L’autorisation de mise sur le marché (AMM) de ces vaccins relève d’une décision de la Commission européenne, qui se prononcera sous peu. Une fois son AMM accordée, un vaccin pourra être administré dans tous les Etats de l’Union européenne (UE). D’autres sont en cours d’examen ou vont être soumis pour avis. Sanofi Pasteur a fait savoir que les essais sur ses vaccins contre le H1N1, dont l’un sans adjuvant, se termineront fin octobre et que les dossiers seraient déposés en novembre.
Pour les deux vaccins auxquels l’EMEA a donné son aval, les industriels ont pu s’appuyer sur les prototypes (» mock-up « ) développés contre le virus de la grippe aviaire H5N1, qui bénéficiaient déjà d’une AMM, et y ont substitué les éléments antigéniques du nouveau virus H1N1 à ceux de la souche virale H5N1. « Des décennies d’expérience avec les vaccins contre la grippe saisonnière indiquent que l’insertion d’une nouvelle souche dans un vaccin ne devrait pas substantiellement affecter la sécurité ou le niveau de protection offerts» , indique le communiqué de l’Agence européenne du médicament.
L’Agence précise que la recommandation favorable est fondée sur des données « incluant l’information sur des essais cliniques sur plus de 6 000 sujets, générées au moment de l’autorisation des vaccins mock-up, de même que l’information en lien avec le changement de souche du H5N1 au H1N1″. Le communiqué indique que des essais cliniques chez l’adulte et chez l’enfant sont toujours en cours et que « des résultats supplémentaires seront disponibles à partir d’octobre-novembre» .
Les deux vaccins antipandémiques évalués contiennent des adjuvants, destinés à renforcer la réponse immunitaire et à réduire la quantité d’antigène nécessaire dans une dose de vaccin. « Ils sont largement utilisés dans la fabrication de vaccins et possèdent un bon dossier de sécurité. L’adjuvant de Focetria a été utilisé pour un autre vaccin antigrippal depuis 1997 dans plus de 45 millions de doses. L’adjuvant de Pandemrix a été testé dans des essais cliniques incluant plusieurs milliers de patients» , explique l’Agence européenne.
L’EMEA ne précise toutefois pas, dans le cas de l’adjuvant de Focetria, si l’âge des populations vaccinées correspond à celui des groupes ciblés dans la future vaccination antipandémique et si les pays où ces vaccinations se sont déroulées disposaient de bons réseaux de pharmacovigilance.
L’EMEA a demandé aux industriels de mettre en place des plans de gestion des risques, destinés à « activement investiguer et surveiller la sécurité des vaccins, aussitôt qu’ils seront utilisés au sein de l’UE» , de façon à agir le plus rapidement possible si nécessaire. Dans ce cadre, « les fabricants se sont engagés à mener des études de sécurité post-AMM sur environ 9 000 patients pour chaque vaccin» , rapporte l’Agence européenne du médicament.