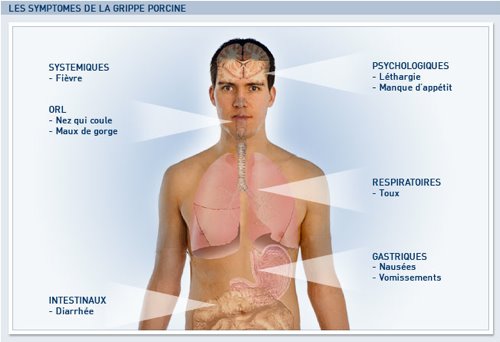
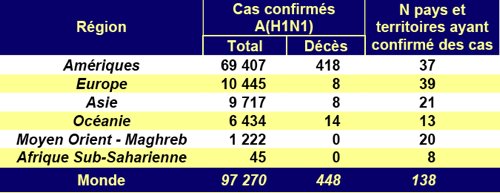
vendredi 25 septembre 2009
Grippe A (H1N1) : L'agence européenne du médicament recommande l'autorisation de deux vaccins
L'Agence européenne pour l'évaluation des médicaments a recommandé vendredi à l'Union européenne d'autoriser la mise sur le marché de deux vaccins contre la grippe A (H1N1), ceux produits par Novartis (photo ci-contre) et GlaxoSmithKine. Dans un communiqué, l'agence européenne recommande pour le moment une vaccination en deux doses, à trois semaines d'intervalle, pour les adultes, y compris les femmes enceintes, et les enfants à partir de six mois. Elle reconnaît toutefois que des données préliminaires laissent penser qu'une dose pourrait être suffisante pour les adultes, et n'exclut pas de revoir ces recommandations dans les mois à venir.
La Commission européenne, qui délivre les autorisations de mise sur le marché des médicaments pour les 27 pays de l'Union européenne (ainsi que l'Islande et la Norvège), rendra sa décision "prochainement", a ajouté l'EMEA.
La Commission se contente généralement de suivre les recommandations de l'Agence, ce que signifie que les Etats qui ont commandé ces deux vaccins pour leurs campagnes de vaccination devraient pouvoir démarrer celles-ci bientôt.
Le Comité d'experts de l'EMEA (European Medicines Agency), chargé d'évaluer scientifiquement l'efficacité et les risques des médicaments à usage humain, a par ailleurs recommandé que les deux vaccins soient administrés en deux doses, avec un intervalle de trois semaines, et a approuvé son utilisation sur les adultes (y compris les femmes enceintes) et les enfants de plus de six mois.
Mais le Comité a cependant reconnu que des données initiales "suggèrent qu'une vaccination en une seule dose pourrait suffire chez les adultes", et ajoute qu'il pourrait donc modifier ses recommandations dans les mois qui viennent, en se basant notamment sur de nouveaux essais cliniques.
L'EMEA a ajouté qu'elle continuait à étudier plusieurs autres vaccins, sans plus de précisions.
.jpg)