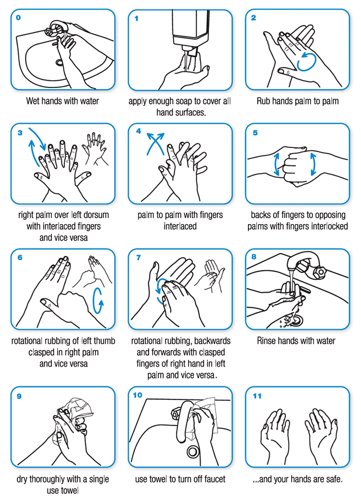
"Bien que de nombreux foyers n'aient pas accès à de l'eau pure pour se laver les mains, le département a retardé l'envoi des désinfectants dans les communautés", de crainte, selon Survival, que "les habitants de ces réserves, qui connaissent des taux élevés d'alcoolisme, ne cherchent à ingérer l'alcool contenu dans les désinfectants". Le rapport aborde également la question des Indiens isolés "qui n'ont aucune immunité face aux maladies exogènes et pour qui un simple rhume peut être fatal". Survival International rappelle que des Indiens matsiguenga, en Amazonie péruvienne, ont déjà été touchés par la grippe A (H1N1), faisant craindre la propagation du virus à des Indiens isolés vivant à proximité. "Tout contact avec des étrangers affectés par le virus pourrait anéantir une communauté entière", avertit l'ONG. "Ce n'est pas surprenant que les plus affectés par la grippe H1N1 soient les peuples indigènes", explique Stephen Corry, directeur de Survival International. "Des années de colonisation, de politiques d'assimilation forcée les ont laissés dans le plus grand dénuement avec des problèmes de santé chroniques".
mercredi 30 septembre 2009
Les peuples indigènes "sérieusement menacés" par la grippe H1N1
"Bien que de nombreux foyers n'aient pas accès à de l'eau pure pour se laver les mains, le département a retardé l'envoi des désinfectants dans les communautés", de crainte, selon Survival, que "les habitants de ces réserves, qui connaissent des taux élevés d'alcoolisme, ne cherchent à ingérer l'alcool contenu dans les désinfectants". Le rapport aborde également la question des Indiens isolés "qui n'ont aucune immunité face aux maladies exogènes et pour qui un simple rhume peut être fatal". Survival International rappelle que des Indiens matsiguenga, en Amazonie péruvienne, ont déjà été touchés par la grippe A (H1N1), faisant craindre la propagation du virus à des Indiens isolés vivant à proximité. "Tout contact avec des étrangers affectés par le virus pourrait anéantir une communauté entière", avertit l'ONG. "Ce n'est pas surprenant que les plus affectés par la grippe H1N1 soient les peuples indigènes", explique Stephen Corry, directeur de Survival International. "Des années de colonisation, de politiques d'assimilation forcée les ont laissés dans le plus grand dénuement avec des problèmes de santé chroniques".
L'Australie commence sa campagne de vaccination contre la grippe A (H1N1)
Grippe A : Une mort mystérieuse dans les Vosges
Grippe A en France : Les fermetures d'écoles en baisse
Grippe A : Le plan de vaccination départemental français se précise
Selon la liste des personnes prioritaires pour la vaccination, chacun recevra un "bon de vaccination". Edité par la caisse nationale d'assurance maladie, ce bon se compose de deux volets correspondant aux deux injections, espacées de 21 jours. Une fois le document reçu, la personne aura 10 jours pour se présenter, sans obligation, dans un centre de vaccination.
Dans le Gard, 10 centres ont été répartis sur le département, chacun couvrant un bassin de 100 000 habitants maximum. Les centres seront installés dans des locaux mis à disposition par les municipalités. Un appel à volontariat a été lancé auprès du personnel médical. Médecins, infirmiers, internes, étudiants en médecine et en soin infirmiers seront mobilisés en équipes de 15 personnes. En plus des centres fixes, des équipes médicales mobiles assureront la vaccination dans les établissements scolaires.
On peut toutefois être inquiet sur la façon dont seront gérés les fameux bons, compte tenu des expériences sur le terrain chaque année lors de la campagne pour la vaccination saisonnière qui connaît de nombreux bugs (doublons, personnes oubliées, listing non à jour, adresses erronées, etc).
mardi 29 septembre 2009
Le Canada adopte une stratégie inverse de la France
lundi 28 septembre 2009
Grippe H1N1 : Risque de rupture de stock du vaccin pneumococcique Pneumo 23
Premier décès au Cambodge dû à la grippe H1N1
Pourquoi cette inquiétude à propos des adjuvants dans les vaccins ?
Ces adjuvants ont été ajoutés à l’antigène grippal pour augmenter la réaction immunitaire à dose d’antigène égale. En effet, c’est l’antigène (signature du virus) qui coûte cher à produire. Il ne s’agit pas de "couper" le produit, mais d’en augmenter l’impact sur le système immunitaire (et donc de produire plus de vaccins avec un même stock d’antigènes). Les adjuvants sont utilisés depuis longtemps avec d’autres vaccins traditionnels comme ceux contre le tétanos ou la coqueluche, l’adjuvant est alors de l’aluminium et la dose d’antigène n’est pas uniquement en cause.
Le vaccin Focetria ® du laboratoire Novartis, utilisé en Europe, qui est fabriqué près de Sienne, possède un adjuvant le MF59. Cet adjuvant, qui a pour effet de booster l’efficacité du vaccin en injectant moins de produit vaccinal, a un profil de sécurité établi, et appuyé par plus de 12 années de données cliniques de sécurité et plus de 40 millions de doses d'utilisation commerciale en Europe. Cet adjuvant a été étudié dans des essais cliniques impliquant plus de 26 000 personnes, dont des enfants, et a obtenu une licence pour une utilisation chez les personnes de 65 ans et plus dans le vaccin contre la grippe saisonnière, Fluad ®, depuis 1997 dans l'Union européenne. Fluad n'est pas homologué pour la vente aux Etats-Unis. Novartis a également l'intention de commencer la livraison de ses Fluvirin ® A (H1N1), vaccin monovalent pour le marché américain d'ici le début Octobre. La Food and Drug Administration américaine a approuvé ce vaccin, le 15 septembre, 2009. Les données provenant d'essais cliniques récents de Fluvirin réalisées au Costa Rica indiquent qu'une stratégie à dose unique est aussi efficace qu'une vaccination effectuée avec deux doses chez des âges adultes en bonne santé de 18 à 64 ans.
 Le vaccin Pandemrix ® du laboratoire Glaxo Smith Kline (GSK), qui est fabriqué à Dresde, possède un adjuvant le squalène. Cet adjuvant est un produit naturel jusqu’ici peu employé comme adjuvant indirect (émulsifiant). Il a néanmoins déjà été utilisé. L’OMS se veut rassurante sur son emploi. Cette argumentation paraît censée, mais l’on aimerait connaître les liens d’intérêt des auteurs de ce texte avec l’industrie du vaccin, très présente auprès des experts qui omettent le plus souvent de déclarer ces liens. D’aucuns font remarquer à juste titre qu’un produit naturel n’est pas forcément anodin lorsqu’il est injecté. Pour prendre un exemple caricatural, une faible dose de potassium injecté par voie veineuse provoque un décès immédiat.
Le vaccin Pandemrix ® du laboratoire Glaxo Smith Kline (GSK), qui est fabriqué à Dresde, possède un adjuvant le squalène. Cet adjuvant est un produit naturel jusqu’ici peu employé comme adjuvant indirect (émulsifiant). Il a néanmoins déjà été utilisé. L’OMS se veut rassurante sur son emploi. Cette argumentation paraît censée, mais l’on aimerait connaître les liens d’intérêt des auteurs de ce texte avec l’industrie du vaccin, très présente auprès des experts qui omettent le plus souvent de déclarer ces liens. D’aucuns font remarquer à juste titre qu’un produit naturel n’est pas forcément anodin lorsqu’il est injecté. Pour prendre un exemple caricatural, une faible dose de potassium injecté par voie veineuse provoque un décès immédiat.Le vaccin français du groupe Sanofi Pasteur, fabriqué sur deux sites, en France à Val-de-Reuil dans l'Eure et aux Etats-Unis, à Swiftwater en Pennsylvanie, manque toujours à l'appel des producteurs. « Ils sont partis un peu en retard et ont dû déposer un nouveau dossier. Le vaccin Panenza ® (dosé à 15 microgrammes, sans adjuvant de Sanofi recevra une autorisation nationale de mise sur le marché courant novembre. Celui contenant un adjuvant Humenza ® dosé à 3,8 microgrammes devrait être prêt vers la fin de l'année », a annoncé Philippe Lechat, directeur de l'évaluation de l'Afssaps.
Pour couper court aux rumeurs, l'Afssaps suggère de réserver les vaccins sans adjuvant aux populations à risque (femmes enceintes et personnes immunodéprimées). « Le Haut Conseil de la santé publique doit actualiser prochainement ses recommandations en fonction des nouvelles données », indique Jean Marimbert. Reste à convaincre une population hexagonale déroutée par la complexité du débat et la diversité des avis face à une épidémie jugée somme toute bénigne. « Nous avons trois semaines avant le démarrage de la campagne de vaccination pour informer la population », estime le directeur général de l'Afssaps.
Focetria et Pandemrix seront les 2 premiers vaccins disponibles en Europe contre la grippe A (H1N1)
Elle recommande un schéma de vaccination en deux doses à trois semaines d’intervalle, chez l’adulte – y compris les femmes enceintes – et les enfants à partir de 6 mois, et attend des données complémentaires pour statuer sur l’administration d’une seule dose de vaccin.
L’autorisation de mise sur le marché (AMM) de ces vaccins relève d’une décision de la Commission européenne, qui se prononcera sous peu. Une fois son AMM accordée, un vaccin pourra être administré dans tous les Etats de l’Union européenne (UE). D’autres sont en cours d’examen ou vont être soumis pour avis. Sanofi Pasteur a fait savoir que les essais sur ses vaccins contre le H1N1, dont l’un sans adjuvant, se termineront fin octobre et que les dossiers seraient déposés en novembre.
Grippe H1N1 : L’Afssaps met en place un dispositif de surveillance renforcé des effets indésirables des vaccins
dimanche 27 septembre 2009
Grippe A (H1N1) : 1er décès au Portugal
samedi 26 septembre 2009
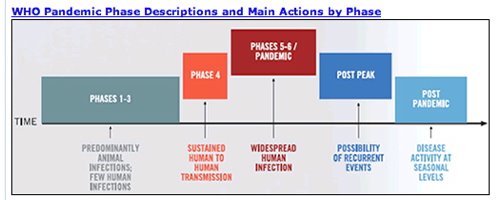
L'OMS toujours méfiante face au virus de la grippe A (H1N1)
"C'est peut-être parce qu'on en aura fait trop qu'on aura évité une catastrophe" : Marc Danzon, directeur de l'OMS pour l'Europe, défend la stratégie de l'organisation face au virus de la grippe A (H1N1).
Directeur depuis dix ans la section européenne de l'Organisation mondiale de la santé, le Français cédera à la fin de l'année la place à la Hongroise Zsuzsanna Jakab. Médecin de formation, il suit de près l'évolution de la grippe A, qui se propage à grande vitesse dans l'hémisphère Nord. "La carte évolue tous les jours", dit-il. "On sait que c'est un virus qui se dissémine rapidement, qui ne touche pas les mêmes populations que celles de la grippe saisonnière, et qui aujourd'hui n'est pas méchant". Face aux recommandations de l'OMS, les pays se sont préparés à des degrés divers, en commandant notamment des vaccins. Certains comme le Danemark ont prévu de vacciner seulement les populations à risque, tandis que d'autres comme la France s'adressent à l'ensemble de leur population. Quelque 94 millions de doses y ont été commandées en vue d'une campagne de vaccination qui doit débuter à la mi-octobre.
Premier décès en Allemagne de la grippe A (H1N1)
vendredi 25 septembre 2009
L'OMS fait le point sur les vaccins contre la grippe pandémique
Capacité de production
En mai 2009, l’OMS a estimé que selon le scénario le plus optimiste, la capacité de production mondiale de vaccins contre la grippe pandémique serait d’environ 5 milliards de doses par an. Depuis, les informations sur la production et la formulation adéquate du vaccin ont été affinées. L’OMS estime actuellement la capacité de production mondiale de vaccins contre la grippe pandémique a environ 3 milliards de doses par an. Si ce chiffre est inférieur au chiffre projeté, les premiers résultats des essais cliniques laissent supposer qu’une dose unique de vaccin sera suffisante pour conférer une immunité protectrice aux adultes en bonne santé et aux enfants plus âgés, ce qui permettra dans la pratique de doubler le nombre de personnes pouvant être protégées au moyen des stocks actuels. Ces stocks resteront insuffisants pour couvrir une population mondiale de 6,8 milliards d’habitants puisque pratiquement tous les individus sont sensibles à l’infection par un nouveau virus très contagieux. Les capacités de fabrication mondiale de vaccin antigrippal sont limitées, insuffisantes et ne sont pas facilement extensibles. Les vaccins contre la grippe pandémique sont le plus efficaces comme moyen de prévention s’ils sont administrés avant le pic de l’incidence des cas lors d’une flambée ou à une date proche de celui-ci. Tant les autorités de réglementation que les fabricants de vaccin ont fait des efforts extraordinaires pour accélérer la mise à disposition des vaccins. De nombreux pays riches avaient déjà commandé aux fabricants des stocks de vaccin suffisants pour couvrir intégralement leur population. Or la plupart des pays à revenu faible ou intermédiaire n’ont pas les moyens financiers nécessaires pour entrer en concurrence avec les pays riches et s’adjuger rapidement une part des stocks limités. Ces pays seront donc largement tributaires des dons de vaccins des fabricants ou d’autres pays.
Mise à disposition dans les pays en développement
La semaine dernière, des dons de vaccins contre la grippe pandémique destines aux pays en développement ont été annoncés par les États-Unis d’Amérique, en même temps que par l’Australie, le Brésil, la France, l’Italie, la Nouvelle-Zélande, la Norvège, le Royaume-Uni et la Suisse. On s’attend à une aide du même type d’autres pays, qui sera accueillie avec soulagement. L’OMS coordonnera la distribution de ces dons de vaccins. Dans le courant de l’année, l’OMS s’est renseignée auprès de ses bureaux régionaux et de pays afin de recenser les pays qui ne disposeront pas de vaccins contre la grippe pandémique à moins de les recevoir en don. Des équipes compétentes en matière d’opérations de terrain, de vaccins et de logistique travaillent actuellement au Centre stratégique JW Lee d’Opérations sanitaires (salle SHOC). Dans un premier temps, ces équipes distribueront, selon les estimations, 300 millions de doses de vaccin à plus de 90 pays. La distribution des premiers lots de vaccins offerts en don devrait débuter en novembre. L’OMS continue à recommander que les agents de santé soient vaccinés en priorité.
Innocuité du vaccin
Les autorités nationales de réglementation des médicaments examinent attentivement les risques et avantages connus et présumés de tout vaccin avant sa mise sur le marché. Le virus de la grippe pandémique étant nouveau, il est procédé à la fois à des essais cliniques et non cliniques pour acquérir des informations essentielles sur la réponse immunitaire et l’innocuité. Les résultats des essais effectués à ce jour laissent supposer que les vaccins contre la grippe pandémique sont aussi sûrs que les vaccins contre la grippe saisonnière. Les effets secondaires devraient être analogues à ceux que l’on observe avec les vaccins contre la grippe saisonnière. Les plus fréquents sont des réactions locales au point d’injection (douleur, gonflement, rougeur) et parfois certaines réactions systémiques (fièvre, céphalée, douleurs musculaires ou articulaires). Chez la plupart des personnes vaccinées, ces symptômes restent bénins, régressent spontanément et ne durent qu’un ou deux jours. Toutefois, même des essais cliniques très étendus ne permettront pas de recenser des manifestations rares , qui peuvent survenir lors de l’administration du vaccin contre la grippe pandémique à plusieurs millions de personnes. L’OMS recommande à tous les pays administrant des vaccins contre la grippe pandémique de procéder à une surveillance minutieuse de l’innocuité et de notifier les manifestations indésirables. De nombreux pays disposent déjà de systèmes de surveillance de l’innocuité des vaccins. L’échange international des données issues de cette surveillance post-commercialisation sera déterminant pour orienter l’évaluation risques-avantages et déterminer si des changements doivent être apportés aux politiques de vaccination. L’OMS a mis au point des protocoles normalisés pour la collecte et la notification des données en temps réel et communiquera les résultats à la communauté internationale sur son site Web.
Grippe A (H1N1) : L'agence européenne du médicament recommande l'autorisation de deux vaccins
Le vaccin contre la grippe saisonnière est disponible en France
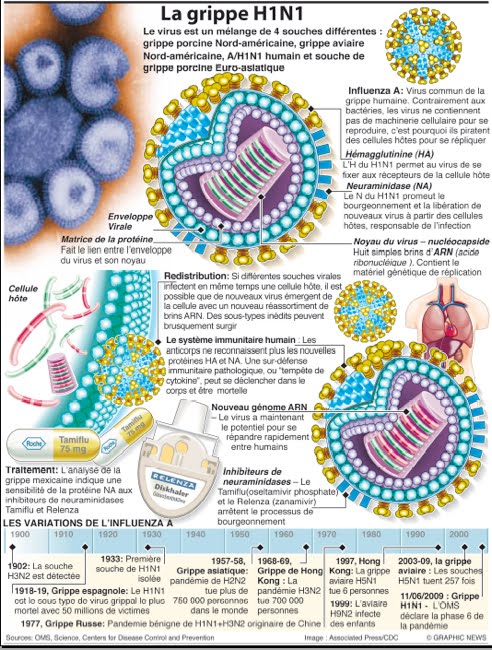
Il existe trois types de grippe saisonnière : A, B et C. Les virus grippaux de type A se subdivisent en sous-types en fonction des différentes sortes et associations de protéines de surface du virus. Parmi les nombreux sous-types des virus grippaux A, les sous-types A (H1N1) et A (H3N2) circulent actuellement chez l’homme. L’actuelle grippe A (H1N1), normalement spécifique à l’espèce porcine, a subi une mutation qui la rend capable d’infecter l’homme chez lequel il n’avait jamais circulé auparavant. H1N1 n’est lié à aucun virus ancien ou actuel de la grippe saisonnière.
jeudi 24 septembre 2009
Un médecin américain utilise le rap et YouTube pour prévenir la grippe A (H1N1)
"For intervention I bring prevention" (pour l'intervention, j'apporte la prévention), peut-on entendre dans l'enregistrement mettant en scène le Dr John Clarke, un médecin de l'Etat de New York, qui a remporté un franc succès sur Internet. La vidéo a séduit plus de 50 000 votants lors d'un concours sur YouTube parrainé par les ministères américains de l'Education et de la Santé. Elle fera partie d'une campagne télévisée nationale. Agé de 38 ans, Clarke est le directeur médical de la Long Island Rail Road. Le médecin, qui recevra un prix de 2 500 $ US pour l'enregistrement, s'est déclaré enchanté que le rap soit utilisé pour livrer des informations aux jeunes gens en matière de santé publique. On peut le voir sur la vidéo, vêtu d'une blouse blanche, donner le conseil de rester à la maison, si nécessaire, pour éviter toute propagation du virus: "If you have it, stay at home, so you don't spread none".
Grippe H1N1 : Fillon détaille le plan de vaccination et tire l'oreille des médecins
Les stratégies de vaccination contre la grippe A au menu d'une réunion à Matignon
mercredi 23 septembre 2009
Vaccination contre la grippe A : L'appel de l'Ordre des médecins français
Le Conseil national de l'ordre des médecins (CNOM) a recommandé mardi 22 septembre aux médecins "de se faire vacciner et d'inciter leurs patients à se faire vacciner" contre la grippe A (H1N1). Cette démarche de l'Ordre intervient à la suite de la publication de plusieurs sondages révèlant une certaine réticence des praticiens vis-à-vis de ces vaccins. "Aujourd'hui, face à une telle pandémie, il est du devoir des médecins, premièrement d'être en état de travailler, deuxièmement de ne pas être le vecteur de la maladie, et enfin d'avoir un comportement exemplaire en protégeant les individus et les familles", déclare Michel Legmann, président du CNOM. Par ailleurs, Roselyne Bachelot a fait savoir lundi 21 septembre qu'"étudiants et internes en médecine seront associés à la campagne de vaccination contre la grippe A". Consciente du climat de suspicion général des Français à l'égard de la vaccination, la ministre de la Santé a invité le même jour les laboratoires pharmaceutiques à rassurer la population "avec la plus grande pédagogie possible".
Les tous premiers résultats des vaccins grippe A (H1N1) indique qu'une seule injection pourrait être suffisante
Une étude (1) a été menée chez 175 adultes de 18 à 50 ans dans le but de tester l’efficacité d’un vaccin monovalent antigrippe H1N1, produit par Novartis, dans sa forme libre ou associée à l’adjuvant MF59 (ou squalène) administré par voie intramusculaire. Les 100 premiers patients inclus ont reçu 2 doses de 7,5 µg de vaccin - MF59 soit administrées de façon concomitante à J0 soit administrées en 2 fois, l’une à J0 et l’autre à J7, 14 ou 21. Des prélèvements sanguins ont été réalisés à J0, J14, J21 et J28 pour mesurer la réponse à anticorps par inhibition de l’hèmaglutination et par un test de microneutralisation.
Les analyses intermédiaires réalisées sur les prélèvements de J14 montrent que les titres d’anticorps et les taux de seroconversion et de séroprotection sont plus élevés chez les sujets ayant reçu la totalité de la dose que chez ceux en attente de la 2ème dose. Par contre à J21, il n’y avait pas de différence significative entre les sujets qui avaient reçu les 2 doses ou ceux n’ayant reçu qu’une dose de vaccin. Les réactions vaccinales (principalement douleur au point d’injection, douleur musculaire, fièvre, céphalée) étaient légères à modérées. Les auteurs concluent que la réponse immunitaire est satisfaisante en moins de 2 semaines après administration d’une dose unique du vaccin dans sa forme associée à l’adjuvant. Ces résultats préliminaires restent à confirmer par de nouvelles études.
Une autre étude (2) réalisée chez 240 sujets par le laboratoire CSL (Australie) a testé l’efficacité d’un vaccin monovalent sans adjuvant, inactivé anti H1N1 à la dose de 15 ou 30 µg d’antigène hémagglutinine administré par voie intramusculaire. Les titres d’anticorps étaient mesurés à J0 et à J21. Les résultats montrent qu’à J21 un titre d’anticorps à 1:40 ou plus était obtenu chez 116 patients sur les 120 ayant reçu la dose de 15 µg (soit 96,7 %) et chez 112 des 120 patients ayant reçu la dose de 30 µg (soit 93,3 %). Les auteurs concluent à l’immunogénicité chez l’adulte d’une dose unique de 15 µg de vaccin anti H1N1. Le haut niveau de protection immunitaire apporté par une dose unique de 15 µg devrait permettre d’assurer plus facilement la logistique des programmes de vaccination H1N1 de masse.
mardi 22 septembre 2009
Grippe A : Un homme soigné au Tamiflu meurt à Unieux
Les médecins ont conclu à un arrêt cardiaque. On sait toutefois que des études montrent une plus grande fréquence des infarctus dans ces circonstances. Bernard M. présentait plusieurs facteurs de risque dont le tabagisme, il avait consulté son médecin le vendredi pour une grippe et s'était vu prescrire du Tamiflu. Une autopsie a été demandée dont les résultats devraient être connus aujourd'hui.
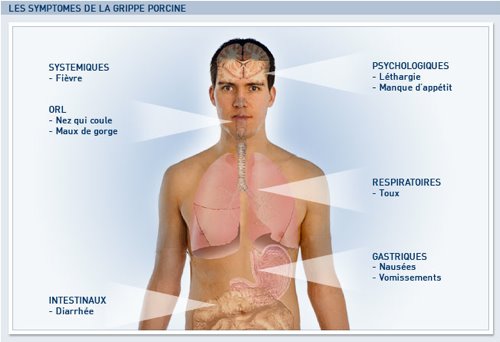
A ce jour, personne ne sait vraiment combien de cas de grippe sont déjà apparus dans la Loire. En revanche, les cabinets médicaux sont débordés de patients présentant des syndromes grippaux : fièvre, courbatures, maux de tête, pour l'essentiel. Le Grog (Groupement régional d'observation de la grippe) estime que 10 à 15 % des syndromes grippaux sont des vraies grippes. Le laboratoire de virologie du CHU de Lyon observe un ratio moindre sur les prélèvements qu'il reçoit.
Le déroulement de la campagne de vaccination sur la grippe A (H1N1) en France
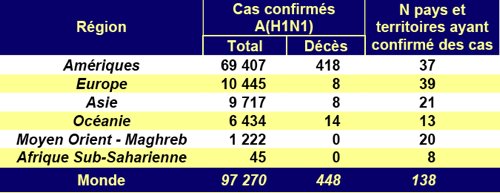
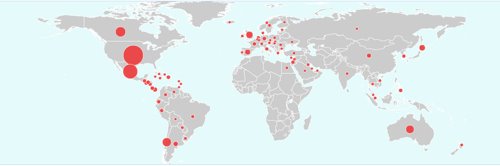
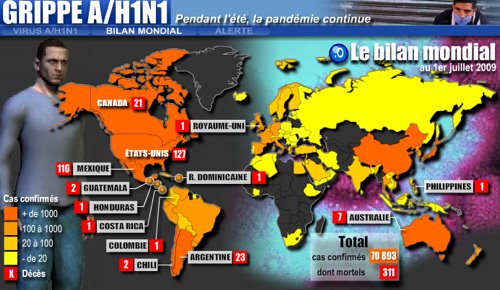
La grippe A (H1N1) a touché 190 pays sur 193
La directrice générale de l'Organisation mondiale de la Santé (OMS) Margaret Chan a déclaré lundi que la fabrication du vaccin contre la grippe A (H1N1) était en bonne voie et que l'idéal serait de produire trois milliards de doses par an. A l'issue de la cérémonie d'ouverture de la 60e session du Comité régional du Pacifique occidental de l'OMS à Hong Kong, Mme Chan a indiqué que beaucoup de pays et régions avaient lancé la fabrication des vaccins antigrippaux. "Après 5 à 6 mois de recherches suite à l'apparition de l'épidémie, la fabrication du vaccin est en bonne voie", a-t-elle expliqué, ajoutant que la Chine était le premier pays à informer l'OMS de la fabrication du vaccin et à immuniser sa population. Selon les données fournies par les laboratoires du monde entier, le virus de la nouvelle grippe a peu changé et aucune mutation n'a été signalée depuis avril, a souligné la directrice de l'OMS. Ainsi, le nouveau vaccin produit devrait être efficace, a-t-elle ajouté. Elle a prévu l'arrivée d'une seconde vague de grippe A (H1N1), plus grave que la précédente, la saison de la grippe approchant. Les ressources médicales doivent être utilisées pour sauver les malades infectés afin de réduire le nombre de cas graves et de décès, a-t-elle appelé. Rappelant qu'un total de 190 pays et régions avaient signalé des cas de grippe A (H1N1), Mme Chan a expliqué que la majorité des cas étaient bénins et que les malades pouvaient guérir sans traitement. Cependant, les malades souffrant d'asthme, de maladies cardiaques, d'obésité et les femmes enceintes doivent faire plus attention. La session durera jusqu'à vendredi. Mme Chan et des experts médicaux venant de 37 pays et régions aborderont des sujets tels que la grippe A (H1N1), le paludisme et le sida .
lundi 21 septembre 2009
Grippe A (H1N1) çà chauffe pas pour tout le monde !
Le vaccin anti-grippe de Sanofi disponible fin novembre
Grippe A : Premier décès en Russie
La vaccination contre le virus de la grippe A (H1N1) a débuté (photo ci-contre)
En Russie, "des dizaines de milliers de cas"
Dimitri Lvov a également estimé que le nombre total de personnes contaminées par le virus en Russie pourrait être beaucoup plus élevé que le chiffre officiel de 90 cas détectés. "D'après mes estimations, il pourrait atteindre des dizaines de milliers de cas. Je ne peux pas encore le prouver, mais dans quelques semaines je serai en mesure de le faire et en ferai état", a-t-il expliqué.
"L'époque où nous pouvions dire que notre frontière était verrouillée est révolue. Pour le virus, c'est une passoire", a-t-il avancé. .
A signaler que cette information a été démentie par la suite faisant de la Russie une nouvelle énigme par rapport à la diffusion de ce nouveau virus.
dimanche 20 septembre 2009
Grippe A : Un décès suspect à Brest
 C’est par le biais d’un simple communiqué de presse que le CHRU de Brest vient d’annoncer le décès d’un patient, porteur confirmé de la grippe A H1N1.
C’est par le biais d’un simple communiqué de presse que le CHRU de Brest vient d’annoncer le décès d’un patient, porteur confirmé de la grippe A H1N1.
Le 18 juillet dernier, une jeune fille de 14 ans était décédée à Brest. Elle était porteuse du virus, selon les premières informations données alors par l’Institut national de veille sanitaire, à la suite de résultats fournis par l’Institut Pasteur. Une des analyses complémentaires effectuées après le décès n’avait toutefois pas trouvé trace du virus. La jeune victime souffrait d’une maladie rare avec déficit immunitaire. Ce nouveau décès suspect intervient alors que l’hôpital de la Cavale Blanche prévoit de dévoiler, mercredi, son plan spécifique en cas de pandémie de grippe A.
Le témoignage de l'épouse :
« Avec nos deux garçons, nous étions en vacances à Figueres, en Espagne. Le mercredi 19 août, mon mari a consulté un médecin. Il n'avait pas de fièvre à ce moment-là, mais il toussait et avait mal à la gorge. Une angine a été diagnostiquée. Nous sommes rentrés le samedi, en train. « Le dimanche, de retour chez nous, à Landéda, dans le Finistère, toute la famille était malade. De la fièvre, un rhume et de la toux. Le dimanche midi, nous avons appelé les urgences, le 15. On a expliqué la situation. Par téléphone, on nous a conseillé de rester au chaud, sous la couette. Mon mari a dormi tout l'après-midi. « Mais dans la nuit, il n'arrivait plus à respirer. Vers 4 h, j'ai appelé le Samu. Les pompiers sont arrivés vers 5 h 15, munis de masque, de combinaison et de gants. Mon mari a été mis sous assistance respiratoire puis transporté aux urgences de l'hôpital de la Cavale-Blanche, à Brest. Diagnostic : pneumonie. Les médecins ont estimé qu'il y avait peu de risque pour que ce soit la grippe A. Mon mari a passé la journée du lundi aux urgences sans protection particulière de la part des soignants. « Le soir, son état s'est aggravé. Il a été transporté en service de réanimation. Finalement, mardi matin, l'hypothèse de la grippe A a été reposée. Un prélèvement a été effectué. L'analyse a été confirmée six heures plus tard, vers 18 h. Le protocole s'est alors mis en place avec masque et combinaison pour les personnels de l'hôpital. « Stéphane souffrait beaucoup. Je crois qu'il a été mis dans un coma artificiel. Trois jours avant son décès, sa tension était montée. Finalement, il est décédé d'une hémorragie cérébrale. Nous n'avons pas demandé d'autopsie. « Ce qui nous choque, c'est qu'on nous a dit de ne pas parler de la grippe A. De dire que Stéphane souffrait d'une pneumonie. La Ddass, l'hôpital... tout le monde nous tenait ce discours-là. On était fin août, il ne fallait pas créer de psychose. « Stéphane était en très bonne santé. Il est décédé à cause d'une complication de la grippe A. Ce n'est pas une maladie anodine. Nous pensons qu'il ne faut pas attendre d'avoir tous les symptômes pour consulter. »
samedi 19 septembre 2009
En France le pic de malades est attendu dans 4 à 8 semaines
L'InVS, qui s'appuie également sur les données de surveillance d'autres réseaux - ceux de SOS Médecins, en ville, et d'"Oscour", aux urgences hospitalières -, estime que celles-ci "montrent une très nette augmentation de l'activité grippale". Le réseau Sentinelles relève un excès du nombre de consultations pour grippe clinique de 93 000 par rapport à la moyenne des années précédentes. Les résultats fournis par le réseau des groupes régionaux d'observation de la grippe (Grog) pour cette 37e semaine de l'année seront connus sous huitaine. Ceux de la semaine précédente font état de 23 000 consultations pour infections respiratoires aiguës liées à la grippe A (H1N1) 2009. De plus, le nombre d'épisodes de cas groupés confirmés s'est lui aussi fortement élevé, avec 42 cas pour la 37e semaine, notamment en milieu scolaire. "La progression rapide et concordante de ces indicateurs" montre que l'épidémie a débuté en France métropolitaine, indique l'InVS, précisant. que "le virus A (H1N1) 2009 est le virus grippal majoritaire en France métropolitaine".
Ce démarrage intervient particulièrement tôt. En 2008, l'épidémie de grippe saisonnière n'avait commencé que dans les dernières semaines de décembre. Cette précocité ne surprend pas totalement et s'explique par les caractéristiques des virus pandémiques. Trois types de facteurs interviennent dans le déclenchement d'une épidémie de grippe : les conditions climatiques ; la capacité du virus à se transmettre entre individus et l'état de protection immunitaire de la population. Or, comme on l'a vu dans le cas de la vague de grippe au Royaume-Uni au cours du mois d'août, les deux derniers facteurs sont réunis : Le H1N1 est hautement transmissible et la population est très peu immunisée contre lui. Dès lors, dans quelle mesure est-il possible de prévoir les conséquences de cette dynamique de l'épidémie ? Il est encore trop tôt pour pouvoir modéliser ce qui va se passer, fait-on valoir à l'InVS. Cependant, l'éventualité d'un pic épidémique survenant dans les 4 à 8 semaines est considérée comme vraisemblable par les épidémiologistes de l'Institut, sachant que, dans le cas des virus saisonniers, le délai est plutôt de 4 à 6 semaines. Pour autant, l'InVS ne dispose pas encore d'assez d'éléments pour déterminer si le début de la vague épidémique sera massive ou non, et si une deuxième vague se profile. Les données d'observations dans l'hémisphère Sud, qui sort de la période hivernale, indiquent que la grippe A (H1N1) n'y a pas pris la forme d'une grosse vague épidémique (au moins 20 % de la population infectée). Rien ne permet donc d'écarter la possibilité que l'épidémie débutante en France métropolitaine ressemble en termes d'intensité à celle qui a touché le Royaume-Uni cet été. Charger le pdf







.jpg)